Без языковых барьеров!
Напишите нам:
info@mdrc-services.com
Или воспользуйтесь формой
Базовый UDI-DI (basic UDI-DI) - что это, где его взять и что с ним делать
С появлением европейских регламентов MDR и IVDR, регулирующих обращение медицинских изделий в Европейском Союзе, появился ряд требований, соблюдение которых необходимо производителям, желающим распространять свою медицинскую продукцию в Европе. Базовый UDI-DI (basic UDI-DI) является одним из таких требований. В данной статье мы рассмотрим, что представляет собой basic UDI-DI, как его можно получить, и как он должен быть использован.
Что такое базовый UDI-DI (basic UDI-DI)
Basic UDI-DI — это идентификатор медицинского изделия на территории Европейского Союза. Его наличие - одно из обязательных требований европейского законодательства в области медицинских изделий. Оно возникло после вступления в силу европейских регламентов MDR 2017/745 и IVDR 2017/746. Необходимость получения и использования базового идентификатора UDI-DI регламентирована статьей 29 MDR и статьей 26 IVDR. Согласно этим статьям, каждый производитель медицинских изделий или изделий для in vitro диагностики обязан получить базовый идентификатор UDI-DI, чтобы легально продавать свои изделия в ЕС.
Более детальные требования к базовому UDI-DI можно найти в разделе C Приложений VI к MDR и IVDR. Дополнительную информацию можно получить из Руководства MDCG 2018-1.
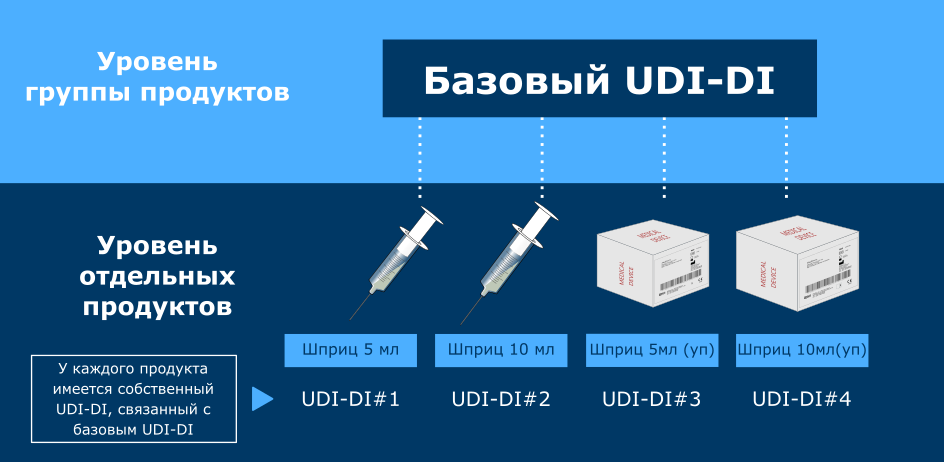
Базовый UDI-DI представляет собой уникальный идентификатор, привязанный к конкретной группе продуктов от одного производителя. Важно не путать базовый UDI-DI с обычным UDI-DI (который не содержит слова "basic" в начале).
UDI-DI представляет собой код, используемый для идентификации отдельных медицинских изделий или их упаковок и сопровождающий штрих-код продукта. Система UDI-DI уже длительное время применяется в США, а с введением MDR и IVDR она также вступила в силу в Европейском Союзе. Важно понимать, что базовый UDI-DI и обычный UDI-DI предназначены для разных целей. Базовый UDI-DI уникален для Европы.
Как получить basic UDI-DI
В основе базового UDI лежит код (префикс) компании, который выдается производителю специальными организациями и который используется для шифрования штрих кодов продукции.
Существует четыре специализированные организации, которые имеют аккредитацию от Европейского Союза на выдачу таких префиксов:
- GS1
- HIBCC (Health Industry Business Communications Council)
- ICCBBA
- IFA GmbH (Informationsstelle für Arzneispezialitäten)
Для получения базового UDI-DI, необходимо применять стандарты кодирования, разработанные одной из указанных организаций. Чтобы выполнить эту процедуру, вам следует обратиться к одной из них.
Из чего состоит базовый UDI-DI
Базовый UDI-DI представляет собой буквенно-цифровой код, состоящий из нескольких компонентов. Давайте разберем структуру базового UDI-DI на примере идентификатора, сформированного в соответствии со стандартами GS1.

Первая часть базового UDI-DI, сформированного в соответствии со стандартами GS1, представляет собой префикс компании, который выдается GS1 при регистрации компании в электронной системе GS1. Затем идет код, который производитель присваивает группе продуктов, используя собственные стандарты. Последние две цифры базового UDI-DI создаются с помощью специального калькулятора, предназначенного для формирования и проверки базовых UDI-DI.
Как группировать продукты для присвоения basic UDI
Базовый UDI-DI может присваиваться не отдельным продуктам, а группам продуктов, объединенных определенными признаками. Таким образом, для присвоения базового UDI-DI необходимо прежде всего сгруппировать продукты - каждая группа получит свой собственный идентификатор. Группировка продукции - это задача производителя.
Для того чтобы продукты могли быть объединены в одну группу, они должны соответствовать следующим критериям:
- Целевое предназначение (intended purpose). Продукты в одной группе должны иметь одинаковое или подобное целевое предназначение, то есть предназначаться для аналогичных медицинских целей или процедур.
- Класс риска. Продукты в группе должны относиться к одному и тому же классу риска, как определено медицинскими регуляторами.
- Устройство. Продукты должны иметь сходное устройство, что означает, что их конструкция и функциональность схожи или имеют общие черты.
- Производственные характеристики. Продукты в группе должны иметь сходные производственные характеристики, такие как материалы, методы изготовления или процессы сборки.
Присвоение базовых UDI-DI и их правильная группировка важны для обеспечения идентификации и отслеживания медицинских изделий в медицинской индустрии, а также для соблюдения требований регуляторных органов.
Как применяется базовый UDI
Базовый UDI-DI представляет собой важную часть документации продукта. Он указывается:
- В сертификатах, выданных нотифицированными организациями.
- В Декларации Соответствия (EU Declaration of Conformity).
- В технической документации.
- В сертификатах свободной продажи (Certificate of Free Sale).
Кроме того, базовый UDI-DI применяется при регистрации продукции в системе EUDAMED и при взаимодействии с нотифицированными организациями.
Вам требуется получить базовый UDI?
Мы поможем вам в его получении.
Свяжитесь
с нами >>
Что вам необходимо иметь, чтобы пройти сертификацию и продавать свою продукцию в ЕС:
PRRC
Узнать >>
Clinical
evaluation
Learn more >>
Post-marketing
surveillance
Learn more >>
О чем вам нужно знать, чтобы пройти сертификацию и продавать свою продукцию в ЕС:
MDR - алгоритм действий
Узнать >>
IVDR - алгоритм действий
Узнать >>
MDR чеклист
Узнать >>
Базовый UDI-DI (basic UDI-DI) - что это, где его взять и что с ним делать
С появлением европейских регламентов MDR и IVDR, регулирующих обращение медицинских изделий в Европейском Союзе, появился ряд требований, соблюдение которых необходимо производителям, желающим распространять свою медицинскую продукцию в Европе. Базовый UDI-DI (basic UDI-DI) является одним из таких требований. В данной статье мы рассмотрим, что представляет собой basic UDI-DI, как его можно получить, и как он должен быть использован.
Что такое базовый UDI-DI (basic UDI-DI)
Basic UDI-DI — это идентификатор медицинского изделия на территории Европейского Союза. Его наличие - одно из обязательных требований европейского законодательства в области медицинских изделий. Оно возникло после вступления в силу европейских регламентов MDR 2017/745 и IVDR 2017/746. Необходимость получения и использования базового идентификатора UDI-DI регламентирована статьей 29 MDR и статьей 26 IVDR. Согласно этим статьям, каждый производитель медицинских изделий или изделий для in vitro диагностики обязан получить базовый идентификатор UDI-DI, чтобы легально продавать свои изделия в ЕС.
Более детальные требования к базовому UDI-DI можно найти в разделе C Приложений VI к MDR и IVDR. Дополнительную информацию можно получить из Руководства MDCG 2018-1.
Базовый UDI-DI представляет собой уникальный идентификатор, привязанный к конкретной группе продуктов от одного производителя. Важно не путать базовый UDI-DI с обычным UDI-DI (который не содержит слова "basic" в начале).
UDI-DI представляет собой код, используемый для идентификации отдельных медицинских изделий или их упаковок и сопровождающий штрих-код продукта. Система UDI-DI уже длительное время применяется в США, а с введением MDR и IVDR она также вступила в силу в Европейском Союзе. Важно понимать, что базовый UDI-DI и обычный UDI-DI предназначены для разных целей. Базовый UDI-DI уникален для Европы.

Как получить basic UDI-DI
В основе базового UDI лежит код (префикс) компании, который выдается производителю специальными организациями и который используется для шифрования штрих кодов продукции.
Существует четыре специализированные организации, которые имеют аккредитацию от Европейского Союза на выдачу таких префиксов:
- GS1
- HIBCC (Health Industry Business Communications Council)
- ICCBBA
- IFA GmbH (Informationsstelle für Arzneispezialitäten)
Для получения базового UDI-DI, необходимо применять стандарты кодирования, разработанные одной из указанных организаций. Чтобы выполнить эту процедуру, вам следует обратиться к одной из них.
Из чего состоит базовый UDI-DI
Базовый UDI-DI представляет собой буквенно-цифровой код, состоящий из нескольких компонентов. Давайте разберем структуру базового UDI-DI на примере идентификатора, сформированного в соответствии со стандартами GS1.

Первая часть базового UDI-DI, сформированного в соответствии со стандартами GS1, представляет собой префикс компании, который выдается GS1 при регистрации компании в электронной системе GS1. Затем идет код, который производитель присваивает группе продуктов, используя собственные стандарты. Последние две цифры базового UDI-DI создаются с помощью специального калькулятора, предназначенного для формирования и проверки базовых UDI-DI.
Как группировать продукты для присвоения basic UDI
Базовый UDI-DI может присваиваться не отдельным продуктам, а группам продуктов, объединенных определенными признаками. Таким образом, для присвоения базового UDI-DI необходимо прежде всего сгруппировать продукты - каждая группа получит свой собственный идентификатор. Группировка продукции - это задача производителя.
Для того чтобы продукты могли быть объединены в одну группу, они должны соответствовать следующим критериям:
- Целевое предназначение (intended purpose). Продукты в одной группе должны иметь одинаковое или подобное целевое предназначение, то есть предназначаться для аналогичных медицинских целей или процедур.
- Класс риска. Продукты в группе должны относиться к одному и тому же классу риска, как определено медицинскими регуляторами.
- Устройство. Продукты должны иметь сходное устройство, что означает, что их конструкция и функциональность схожи или имеют общие черты.
- Производственные характеристики. Продукты в группе должны иметь сходные производственные характеристики, такие как материалы, методы изготовления или процессы сборки.
Присвоение базовых UDI-DI и их правильная группировка важны для обеспечения идентификации и отслеживания медицинских изделий в медицинской индустрии, а также для соблюдения требований регуляторных органов.
Как применяется базовый UDI
Базовый UDI-DI представляет собой важную часть документации продукта. Он указывается:
- В сертификатах, выданных нотифицированными организациями.
- В Декларации Соответствия (EU Declaration of Conformity).
- В технической документации.
- В сертификатах свободной продажи (Certificate of Free Sale).
Кроме того, базовый UDI-DI применяется при регистрации продукции в системе EUDAMED и при взаимодействии с нотифицированными организациями.
Похожие статьи
Сроки и дедлайны для legacy devices в рамках поправок к IVDR
Клиническая оценка, PMCF, PMS, и какая между ними связь
СЕ-марка – примеры из практики
Как часто следует обновлять Отчет о клинической оценке (CER)?
Внедрение MDR – проблемы и решения
Регламент Европейского Союза для Медицинских Изделий (MDR) – основы
Как получить CE-маркировку для медицинского программного обеспечения в соответствии с MDR или IVDR?
Больше статей
Сертификат CE и сертификат EC для медицинских изделий: что это за сертификаты и который из них нужен мне
Базовый UDI-DI (basic UDI-DI) - что это, где его взять и что с ним делать
Регистрация в EUDAMED - краткая инструкция
Договор с Уполномоченным представителем в Европейском Союзе (мандат Уполномоченного представителя)
GSPR – общие требования к медицинским изделиям в Европейском Союзе
Как получить CE-маркировку для медицинского программного обеспечения в соответствии с MDR или IVDR?
Техническая документация для медицинского программного обеспечения (MDSW) в Европейском Союзе
Как зарегистрировать медицинское изделие в ЕС
IEC 62304 - стандарт для медицинского программного обеспечения
Как определить класс медицинского изделия согласно MDR
Регламент Европейского Союза для Медицинских Изделий (MDR) - основы
Стандарты ISO и IEC для медицинского программного обеспечения
СЕ-марка - примеры из практики
CE-марка для медицинских изделий - вопросы и ответы
Клиническая оценка, PMCF, PMS, и какая между ними связь
Нотифицированные организации ЕС и их роль в сертификации медицинских изделий
Что такое NANDO и почему о ней должны знать производители медицинских изделий?
Требования к маркировке и UDI для медицинских изделий в ЕС
Роль Уполномоченного представителя и импортера в рамках MDR/IVDR
Внедрение MDR – проблемы и решения
Постмаркетинговый надзор в соответствии MDR и IVDR
Как пройти сертификацию медицинского изделия в ЕС
План менеджмента рисков для медицинских изделий
GDPR и медицинские изделия
ЕС-сертификат на медицинское изделие - вопросы и ответы
Сколько времени требуется, чтобы получить CE-марку для медицинского изделия
Кто такой PRRC?
Требования, предъявляемые к импортерам и дистрибьюторам медицинских изделий в Европейском Союзе
Языковые требования к инструкциям и этикеткам для медицинских изделий согласно MDR и IVDR
Легальный Производитель и Оригинальный Производитель медицинских изделий
Что должно быть в контракте с PRRC
Как создать декларацию соответствия MDR или IVDR
Все статьи >>
Без языковых барьеров!
Свяжитесь с нами по электронной почте: info@mdrc-services.com
Или воспользуйтесь формой для контактов